مركب هيدروكربوني أوليفيني بسيط غير مشبع , ترتبط ذرتا الكربون فيه برابطة زوجية.
يوجد الإيثين في غاز الفحم وفي الغاز الطبيعي .
الصيغة الكيميائية
C2H4
الوزن الجزيئي
28.05 جم/ مول
التركيب الكيميائي
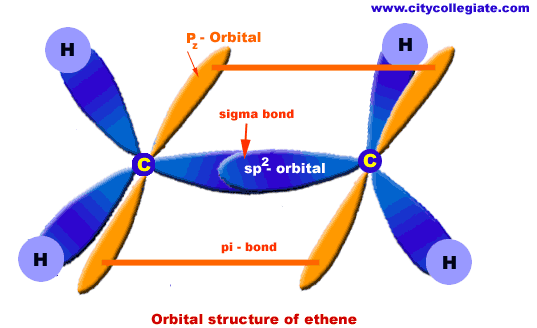
التركيب المداري
الخواص الفيزيائية للإيثين ( الإيثيلين )
الإيثين غاز عديم اللون حلو الطعم نوعاً ما , له رائحة حلوة مميزة , عديم الذوبان في الماء لكنه يذوب في الكحول أو الإيثر , قابل للإشتعال .
تبلغ درجة غليانه(-103.7) درجة مئوية , بينما تبلغ درجة انصهاره (-169.1) درجة مئوية .
تحضير الإيثين ( الإيثيلين ) في الصناعة
تعتمد خطوات صناعة الإيثيلين على التكسير والإنضغاط وأخيراً التنقية .
ويتم الحصول على الإيثيلين في الصناعة من ثلاثة مصادر رئيسية هي :
1- الإيثان والبروبان أو تغذية مكونة من عدة مكونات مثل سوائل الغاز الطبيعي , وتبلغ نسبة الإيثيلين المنتج من هذا المصدر حوالي 62 % .
C2H6(g) = C2H4(g) + H2(g)x
C3H8(g) = C2H4(g) + CH4(g)x
2- غازات المصافي ( تشمل على الإيثان والبروبان ) وتنتج حوالي 25 % ايثيلين .
3-النفثا بأنواعها الثلاثة ( الخفيفة , المتوسطة , الثقيلة ) وزيت الغاز والجازولين الطبيعي وتعطي أقل نسبة إيثيلين والتي تبلغ حوالي 13 %
تحضير الإيثين( الإيثيلين ) في المختبر
يتم تحضير الإيثيلين في المختبر بتسخين الكحول الإيثيلي ( الإيثانول ) مع حمض الكبريتيك المركز عند درجة 160 درجة مئوية , حيث يعمل حمض الكبريتيك على الإزالة الكاملة لجزئ الماء من جزئ الإيثانول .
CH3CH2OH + H2SO4 -------> H2C=CH2 + H2O
ويجمع الإيثيلين بالإزاحة السفلية للماء .
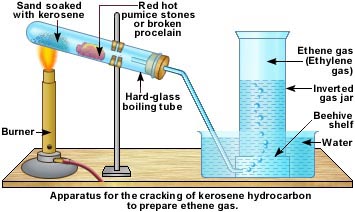
طرق أخرى لتحضير الإيثين
1 -التكسير الحراري
يمكن تحضير الإيثين في المختبر بطريقة أخرى تعتمد على تكسير جزيئات الألكانات الكبيرة بالتسخين في وجود عوامل مساعدة و مادة مهدئة للتفاعل مثل حجر الخفاف أو البورسلين لتتحول الى عدة نواتج ذات جزيئات صغيرة ولكن أكثر هذه النواتج حصيلة هو مركب الإيثين .
مثال :
أيضاً في هذه الحالة يجمع الإيثين بالإزاحة السفلية للماء .
هذه الطريقة تعطي إيثين غير نقي بسبب تكون عدة جزيئات أخف من الماء وعديمة الذوبان فيه كما هو الحال في الإيثين .
2 - تحضيره من ثنائي الهاليد المتجاور.
يفقد ثنائي كلوريد الإيثان ذرتي الهاليد ( ذرتي الكلور ) المتجاورتين إذا ما عومل بمحلول يوديد الصوديوم في الأسيتون أو بمسحوق الزنك في حمض الخل ليتكون الإيثين .
CH2Cl-CH2Cl + Zn -------> CH2=CH2 + ZnCl2
3 - إنتزاع هاليد الهيدروجين من كلوريد الإيثيل
يمكن أن يتم إنتزاع هاليد الهيدروجين من كلوريد الإيثيل إذا ما عومل الأخير بقاعدة مناسبة مثل هيدروكسيد البوتاسيوم المذابة في الكحول الايثيلي .
CH3-CH2Cl + KOH --------> CH2=CH2 + KCl + H2O
4 - هدرجة الايثاين (الاسيتيلين)
في ظروف معينة يتكون الإيثين عند إضافة الهيدروجين الى الإيثاين في وجود النيكل عند درجة 200 درجة مئوية .
C2H2 + H2 --------> CH2=CH2









 رد مع اقتباس
رد مع اقتباس
مواقع النشر (المفضلة)